1.1 Teori Dasar
Warna bahan pangan merupakan hal yang penting dan sering digunakan sebagai indeks kesegaran dan peningkat daya tarik konsumen. Kebanyakan bahan pangan secara alami memiliki warna khas, sedangkan bahan pangan lain ada yang tidak berwarna. Warna bahan pangan dapat berubah selama penyimpana. Hal ini yang mendorong bagi produsen pangan untuk menambahkan pewarna makanan untuk mempertahankan warna alami atau memang sengaja mewarnai makanan dengan pewarna sintetis atau pewarna alami untuk meningkatkan daya tarik. Kecuali riboflavin, beta karoten, dan apokarotenal, bahan pewarna lainnya tidak memiliki nilai gizi.
Pewarna pangan sering kali disalahgunakan yaitu untuk memberikan kesan segar pada makanan, terlihat bergizi, lebih segar, dan lebih bersih. Penyalahgunaan dapat berupa penggunaan pewarna sintetis bukan untuk pangan (misal: pewarna tekstil) atau pewarna pangan yang ditambahkan dalam jumlah yang berlebihan. Hal ini terutama karena potensi toksisitasnya dan hal tersebut termasuk dalam tindak kejahatan penipuan terhadap konsumen agar pangan terlihat bergizi, segar, dan bersih.
Pewarna yang ditambahkan ke dalam formulasi pangan dapat berupa pewarna alami atau pewarna sintetik. Pewarna alami dapat berupa pigmen yang diesktrak atau diproses dari bahan segar misalnya klorofil daun suji, antosianin dari ekstrak kulit anggur dan lainnya. Codex Alimentarius Commission (CAC) telah merekomendasikan jenis-jenis pewarna alami dan sintesis yang dapat digunakan untuk pengolahan pangan. Jenis pewarna alami yang dapat digunakan antara lain: beta karoten (kuning), karotenoid (kuning), ekstrak annato (merah), antosianin (merah), klorofil (hijau), kurkumin (kuning), bit (merah), dan riboflavin (kuning). Karamel dari hasil karamelisasi gula sederhana (misal: sukrosa) juga termasuk jenis pewarna alami yang diizinkan. Disisi lain, Jenis Pewarna Sintetik yang diizinkan antara lain: biru berlian, hijau FCF, karmoisin, kuning FCF, kuning kuinolin, ponceau 4R, tartrazin, eritrosin, indigotin, merah allura, dan coklat HT.
1.2 Pewarna Alami
Adanya warna pada buah-buahan dan sayuran disebabkan oleh komponen pada jaringan alami yang diserap oleh cahaya pada panjang gelombang tertentu. Pigmen ini menghasilkan banyak sekali grup senyawa yang berbeda-beda, terstruktur, dan memiliki konsentrasi yang berbeda tergantung pada jenis tumbuhan, tingkat kematangan, dan kondisi pertumbuhan. Pigmen alami dibedakan menjadi 2 kelompok berdasarkan bentuk strukturnya yaitu senyawa yang tersusun dari ikatan rangkap terkonjugasi dan senyawa dengan cincin porphyrin terkoordinasi logam (tersusun ikatan rangkap terkonjugasi. Karotenoid dan antosianin termasuk ke dalam kelompok 1, sedangkan klorofil termasuk ke dalam kelompok 2.
1.3 Pewarna Sintetik
Pewarna yang disertifikasi adalah komponen organik sintetik. Diantara jenis pewarna sintetik yang direkomendasikan oleh CAC dapat dilihat di tabel bawah. Setiap jenis pewarna memiliki International Number System (INS). Penomoran ini ditujukan untuk menghindari kekeliruan antar pewarna.
Kebanyakan pewarna sintetik tersebt berupa garam dari asam sulfonat. Pewarna ini akan mengionisasi dan bermuatan negatif pada pH pangan secara umum. Karakter ioniknya ini membuatnya mudah larut air. Pewarna pangan ditambahkan dalam konsentrasi rendah. Oleh sebab itu, untuk mengekstraksinya dilakukan dengan mengikatkan pewarna pada wool dan kemudian membebaskannya ke dalam larutan lain.
1.4 Pengikatan pada Wool
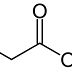
Karena pewarna ditambahkan dalam konsentrasi rendah, maka untuk memekatkannya dilakukan dengan memanfaatkan adanya interaksi elektrostatik antara molekul pewarna dengan protein, dalam hal ini wool. Protein wool merupakan senyawa pengikat yang cocok untuk tujuan ini karena bersifat tidak larut dan muatannya dapat dimanipulasi oleh perubahan nilai pH. Pada pH rendah, grup karboksil dan asam amino pada protein wool akan diprotonasi, sehingga protein wool memiliki muatan total positif. Sebaliknya, molekul pewarna tetap bermuatan negatif pada pH rendah karena merupakan garam dari asam kuat. Asam asetat yaitu asam lemah dapat digunakan untuk mengasamkan pangan sehingga ketika wool ditambahkan akan terprotonasi.
Ikatan elektrostatik antara molekul protein bermuatan positif dan molekul pewarna bermuatan negatif merupakan ikatan yang terdapat antara pewarna dengan serat wool, meskipun ada juga ikatan hidrogen dan interaksi hidrofobik.
Jika molekul pewarna terikat pada wool dibawah kondisi tersebut, maka pencucian dengan air dingin tidak akan melunturkan warna. Hal ini menunjukkan interaksi yang kuat antara pewarna dengan wool.
1.5 Pembebasan dari Wool
Pendidihan benang wool dalam larutan basa encer mendeprotonasi grup amino pada protein wool. Hal ini akan memecah ikatan elektrostatik dan membebaskan warna pada benang ke larutan.
1.6 Identifikasi Pewarna Sintetik
Separasi dan identifikasi pewarna sintesis dapat dilakukan secara sederhana dengan cara menguji beberapa reagen/pereaksi yaitu HCl pekat, H2SO4 pekat, NaOH 10%, dan NH4OH 12%. Setiap jenis pewarna sintesis akan memberikan respon perubahan warna yang spesifik. Berikut perubahan warna pada pewarna sintetik dalam beberapa jenis reagen:
1.7 Ekstraksi Pigmen Alami dan Sintesis
Alat :
(#) Timbangan Analitik
(#) Waring Blender
(#) Kertas saring Whatman No.1
(#) Tabung Reaksi
(#) pH Meter
(#) Gelas Piala 600 ml
(#) Oven
(#) Batu didih
(#) Hot Plate
Pereaksi:
(#) Campuran Aseton-Buffer Fosfat pH 8 (80:20, v/v)
(#) Air Deionisasi
(#) Asam Asetat 5 N
(#) Larutan NH4OH 0.5N
Bahan:
(#) Sumber Pigmen Alami: Daun Suji, Kunyit, Bit, Bunga rosella, kulit pohon secang
(#) Sumber Pigmen Sintesis: Pigmen gelatin bewarna dan minuman bewarna
(#) Benang wool putih yang telah dimurnikan terlebih dahulu dengan merebusnya dalam 0.01N NaOH, kemudian dididihkan dengan air panas.
Prosedur Kerja:
1.1.7 Ekstraksi Pigmen Alami Larut Lemak
- Siapkan contoh sumber pigmen alami larut lemak dengan 2 perlakuan yaitu dalam keadaan segar dan yang telah dikukus dahulu selama 10 menit
- Timbang masing-masing 10 gram contoh tersebut;
- Hancurkan sampel dengan mortar/blender, kemudian tambahkan 100 ml aseton buffer fosfat pH 8.0
- Saring dan ambil bagian filtratnya;
- Ukur pH filtrat;
- Bandingkan warna dan intensitasnya antara ekstrak pigmen mentah dan matang.
1.2.7 Ekstraksi Pigmen Alami Larut Air
- Siapkan contoh sumber pigmen alami larut air dengan 2 perlakuan yaitu dalam keadaan segar dan yang telah dikukus dahulu selama 10 menit;
- Timbang masing-masing 10 gram contoh tersebut;
- Hancurkan sampel dengan mortar/blender, kemudian tambahkan 100 ml air deionisasi dan blender selama 2 menit. Saring dan ambil bagian filtratnya. Khusus untuk rosela dan secang diesktrak dengan menggunakan air panas.
- Ukur pH filtrat
- Bandingkan warna dan intensitasnya antara ekstrak pigmen mentah dan matang.
1.3.7 Ekstraksi Pewarna Sintesis dari Produk Pangan
- Siapkan contoh pangan bewarna (permen jeli/gelatin/minuman)
- Masukkan 50 ml contoh minuman/ sampel ke dalam 100 ml gelas piala dan asamkan dengan 1 ml asam asetat 5N
- Masukkan 2,5 gram produk gelatin ke dalam 100 ml gelas piala. Larutkan dalam 50 ml air dan asmakan dengan 1 ml asam asetat 5N
- Masukkan 20 cm benang wool (purified white knitting wool) ke dalam contoh yang telah diasamkan.
- Tambahkan batu didih dan didihkan campuran hingga benang wool menyerap warna sebanyak mungkin. Lalu didinginkan;
- Cuci benang wool dengan air dingin, pindahkan ke dalam gelas piala kecil. Tambahkan batu didih dan 10 ml larutan NH4OH 0.5N. Didihkan perlahan hingga warna terlepas ke dalam larutan. Kemudian angkat benang wool.
- Untuk keperluan identifikasi. Lakukan pemekatan dengan cara memasukkan gelas piala tersebut ke dalam oven 95 derajat celcius hingga larutan hampir kering ataupun uapkan dengan menggunakan hot-plate.
Alat :
(#) Gelas Piala 500 ml
(#) Gelas Ukur 10 dan 50 ml
(#) Gelas arloji
(#) Pipet & tips
(#) Gelas arloji
(#) Pipet & tips
(#) Kertas saring Whatman No.1
(#) Tabung Reaksi & raknya
(#) pH Meter
(#) Blender
(#) Oven 95 C
(#) Batu didih
(#) Timbangan
(#) Water bath, Penangas Air
(#) Timbangan
(#) Water bath, Penangas Air
(#) Hot Plate
Pereaksi:
(#) Buffer sitrat-fosfat-borat-HCl (pH 3, 6, dan 9)
(#) Larutan FeCl3, AlCl3, dan SnCl2 (0.02%)
(#) Soda Kue
(#) HCl 1N
(#) Soda Kue
(#) HCl 1N
(#) Air Deionisasi
Bahan:
(#) Ekstrak Pigmen Alami: Bayam, Kunyit, Bit mentah dan matang
(#) Ekstrak Pigmen Sintetik: Pigmen gelatin bewarna dan minuman bewarna
(#) Beberapa pewarna sintetik
Prosedur Kerja:
1.1.8 Pengaruh pH terhadap Stabilitas Warna Ekstrak Pigmen Alami/Sintetik
- Siapkan 3 buah tabung reaksi di dalam rak. Tambahkan 5 ml larutan bufer dengan pH yang sesuai yaitu pH 3, 6, dan 9;
- Tambahkan masing-masing dengan 2 ml sampel hasil ekstrak pigmen alami ataupun sintetik yang telah diencerkan (0.5 ml diencerkan dengan akuades hingga 50 ml), lalu aduk;
- Ukur pH campuran bufer-ekstrak dan catat perubahan warna yang terjadi secara visual.
1.2.8 Pengaruh Logam & Pemanasan terhadap Stabilitas Warna Ekstrak Pigmen Alami/Sintetik
- Masukkan 2 ml sampel baik ekstrak pigmen alami atau sintetik ke dalam tabung reaksi (masing-masing 5 tabung reaksi per sampel)
- Ke dalam 3 tabung reaksi berisi contoh, kemudian tambahkan 0.5 ml larutan FeCl3, AlCl3,dan SnCl2. Tutup dan aduk secara merata;
- Dua tabung reaksi lain diisi dengan 0.5 ml air deionisasi;
- Ketiga tabung reaksi (penambahan dengan larutan garam) dan satu tabung reaksi berisi air deonisasi diletakkan ke dalam penangas air 90 derajat celcius untuk dipanaskan selama 5 menit;
- Satu tabung tersisa digunakan sebagai kontrol (tanpa perlakuan penambahan garam dan pemanasan)
- Amati perubahan warna dan intensitas warna untuk masing-masing perlakuan yang berbeda.
1.3.8 Stabilitas Pigmen Daun Tanaman
- Siapkan daun bayam yang bersih dan telah dicuci;
- Siapkan 4 gelas piala 500 ml. Masukkan masing-masing 300 ml air, kemudian didihkan;
- Masukkan 5 lembar daun bayam ke dalam gelas piala tersebut, kemudian lakukan sebagai berikut: (a) Gelas Piala 1: tanpa ditutup, (b) Gelas Piala 2: ditutup dengan gelas arloji, (c) Tambah 0.5 gram soda kue dan diaduk rata, (d) Tambah 10 tetes HCl 1N dan diaduk rata;
- Biarkan mendidih selama 5 menit
- Angkat, tiriskan, dinginkan;
- Bandingkan perubahan warna daun bayam dan air rebusan dari 4 perlakuan tersebut.
1.9 Identifikasi Pewarna Sintetik
Alat:
(#) Gelas Piala 500 ml
(#) Plate Porselen berlubang
(#) Pipet tetes
Pereaksi:
(#) Pipet tetes
Pereaksi:
(#) Larutan HCl pekat;
(#) Larutan H2SO4 pekat
(#) Larutan NaOH 10%
(#) Larutan NH4OH 12%
(#) Larutan Asam Asetat Encer 0.1M
(#) Larutan NaOH 10%
(#) Larutan NH4OH 12%
(#) Larutan Asam Asetat Encer 0.1M
Bahan:
(#) 6 jenis larutan pewarna sintetis
(#) Tahu putih
(#) Pewarna tahu ekstrak kunyit (10g/100 ml air) disaring
(#) Pewarna tahu dari pewarna sintetik (2g/100 ml air)
Prosedur Kerja:
1.1.9 Identifikasi Pewarna Sintetik Berdasarkan Reaksi Perubahan Warna
- Siapkan berbagai pewarna sintetis tanpa diberi identitas
- Tempatkan masing-masing sebanyak 2 tetes larutan pewarna ke dalam porselen;
- Tetesi ke-5 lubang tersebut berturut-turut: HCl pekat, H2SO4 pekat, NaOH 10%, dan NH4OH 12%. Lubang ke lima sebagai kontrol (tanpa ditetesi apapun). Kerjakan diruang asam.
- Amati perubahan warna dan identifikasi jenis pewarna tersebut dengan membandingkan dengan standar perubahan warna
1.2.9 Aplikasi Pewarna Sintetik dan Alami dalam Sistem Pangan
- Siapkan 2 buah tahu putih dengan ukuran yang seragam;
- Rendam masing-masing dalam pewarna kuning sintetik dan alami ekstrak kunyit selama 30 menit;
- Angkat tahu, kemudian amati warna dan penampakan tahu;
- Amati juga keseragaman warna di permukaan tahu maupun dibagian dalam (penetrasi warna kedalam);
- Tetesi permukaan tahu dengan larutan asam (as.asetat) dan larutan basa (NaOH) dan amati perubahan warna yang terjadi.










No comments:
Post a Comment